骨・関節手術部位感染の現状
骨・関節の手術部位感染(Surgical Site Infection : SSI)は、人工関節置換術や脊椎インストゥルメンテーション手術における術後の重大な合併症の1つであり、その治療に難渋することが多く、再発を繰り返して、患肢切断に至ることもあります。
深部SSI発生率は、以下の様になっています。(図1)(文献1)

図1.深部SSI発生率
全国の日本整形外科学会認定研修施設2,241施設にて2004年1月から12月までに施行された初回手術を対象とした調査結果によると、SSIの発生頻度は、人工関節置換術で9,882例中134例(1.36%)、脊椎インストゥルメンテーション手術で2,469例中92例(3.73%)に感染を認めたと報告されています。
またその起炎菌は、薬剤耐性菌であるMRSAとMRSEで46%(人工関節置換術)、44%(脊椎インストゥルメンテーション手術)を占めていました。(表1)(文献2)
(MRSA:メチシリン耐性黄色ブドウ球菌、MRSE:メチシリン耐性表皮ブドウ球菌)
| SSI of artificial joint replacement(134cases) |
|
|---|---|
| MRSA(メチシリン耐性黄色ブドウ球菌) | 56 cases (42%) |
| Staphylococcus aureus(黄色ブドウ球菌) | 23 (17%) |
| Staphylococcus epidermidis(表皮ブドウ球菌) | 15 (11%) |
| Pseudomonas aeruginosa(緑膿菌) | 5 (4%) |
| MRSE(メチシリン耐性表皮ブドウ球菌) | 5 (4%) |
| Escherichia coli(大腸菌) | 5 (4%) |
| Anaerobic bacteria(嫌気生物) | 3 (2%) |
| Others(その他) | 10 (8%) |
| Unknown(不明) | 12 (9%) |
表1.人工関節置換術におけるSSIの起炎菌
AG-PROTEXの概要
AG-PROTEX(エージープロテクス)は、抗菌スペクトルの広い銀を含有した、ハイドロキシアパタイト(HA)の溶射技術です。
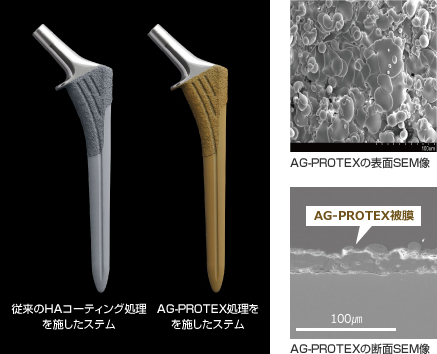
図2.AG-PROTEXの表面及び断面SEM像
京セラのHAコーティングはセメントレス人工関節の骨接合面に適用され、10年以上の臨床成績を有しています。(文献3) 今回、このHAコーティングの骨伝導性を維持しつつ、さらに銀の抗菌性を加えた、独自の溶射技術を開発しました。(文献4)
AG-PROTEXは、銀による抗菌性とHAによる骨伝導性、骨固定性を両立することに初めて成功しました。
AG-PROTEXは、セメントレス人工関節の骨との接合部分に適用され、インプラント表面に抗菌性、骨伝導性及び骨固定性を付与します。
AG-PROTEXの抗菌メカニズム

図3.バイオフィルム形成のプロセスイメージ
人工関節手術に関連するSSIは、インプラント関連感染 (Implant related infection)または、インプラント周囲感染(Peri-prosthetic joint infection : PJI)と呼ばれ、
感染発症や重篤化にバイオフィルムが関与していることが知られています。(文献5)
バイオフィルム中の細菌には抗菌薬が効きにくく、さらにMRSAなどの薬剤耐性菌の増加により、治療に難渋することになります。
AG-PROTEXは銀イオンを溶出し、銀イオンの殺菌効果によりAG-PROTEX表面への細菌付着を低減させます。その結果として、表面へのコロニー形成やバイオフィルム形成の阻害効果(※)を示します。
即ち、バイオフィルム形成の初期段階を阻害することが期待されます。
※In vitro試験にて確認
AG-PROTEXの抗菌性
細菌付着阻害試験
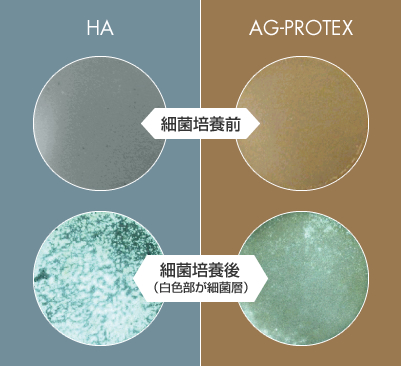
図4.細菌付着阻害試験結果
AG-PROTEXの細菌付着阻害能を評価したところ、HA表面は細菌(MRSA、白色部)に覆われており、細菌被覆率は88%でした。 一方、AG-PROTEXの表面では、細菌被覆率は9%と少なく、AG-PROTEXは細菌付着阻害効果を有することが確認されました(図4)。(文献6)
【試験概要】
AG-PROTEXおよびHA試験片(直径20mm)へ105CFU(コロニー形成単位)のMRSAを接種し、37℃、24時間培養後、PBS(リン酸緩衝生理食塩水)で洗浄して浮遊菌を洗い流した。 洗浄後の試験片を乾燥後、試験片上の生菌のコロニーを光学顕微鏡にて観察し、画像解析を行って細菌被覆率(試験片表面において生菌のコロニーで覆われている部分の面積割合)を算出した。図4で白色の部分が細菌のコロニーである。
バイオフィルム形成阻害試験
AG-PROTEXのバイオフィルム形成阻害能を評価したところ、バイオフィルムの平均被覆率は、培養1日でHA表面は21.2%でした。一方、AG-PROTEXの表面は8.8%でした。
培養期間3日ではAG-PROTEXはHAに対してバイオフィルム被覆率の有意な低下を認めなかったものの、3日を除く前後の培養期間では、いずれの期間においてもAG-PROTEXはHAに対してバイオフィルム被覆率を有意に低下させることを確認しました。従って、これら各培養期間の試験結果全体の傾向から判断し、AG-PROTEXは培養期間3日を含む28日までの間、バイオフィルム形成阻害効果を有しているものと考えました(図5)。
培養期間3日の結果については、他の培養期間の結果の傾向と比べて、HAのバイオフィルム被覆率が相対的に低く、異なる傾向を示しましたが、原因の特定は困難でした。
なお、培養期間3日のみの追加試験において、AG-PROTEXのバイオフィルム被覆率はHAの場合よりも統計学的に有意に低いことを確認しました。
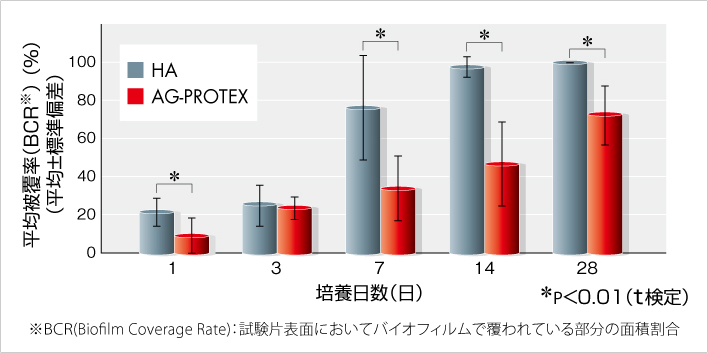
図5.バイオフィルム形成阻害試験結果(社内データ)(n=35)
【試験概要】
AG-PROTEXおよびHA試験片(直径14mm)へ105CFUのMRSAを接種し、37℃、1時間培養後、PBSで洗浄して浮遊菌を洗い流した。その後、試験片を2枚または3枚ずつ牛血清15mLの入ったシャーレ(直径90mm)内に設置し、スターラーで撹拌(60rpm)しながら、37℃で最長28日間培養した。 なお培養期間中、2~3日おきに培地を交換した。所定期間培養終了後の試験片を回収し、PBSで洗浄して浮遊菌を洗い流した後、蛍光染色液にてバイオフィルムを染色した。試験片表面のバイオフィルムを蛍光顕微鏡で観察し、画像解析を行ってバイオフィルム被覆率を算出した。
AG-PROTEXの抗菌スペクトル
In vitro の JIS抗菌試験の結果、感染症の原因となる下記6種類の細菌に対して抗菌性を有していることが確認されています。更に、MRSAについては14日間の試験が実施され抗菌性が持続することが確認されました(表2)。(文献2、7)
| 細菌名称 | 抗菌性 |
|---|---|
| あり | |
| あり | |
| あり | |
| あり | |
| あり | |
| あり |
表2.抗菌性を確認した細菌
【試験概要】
JIS Z 2801規格を参考としたフィルム密着法抗菌試験を行った。AG-PROTEXおよびHA試験片(縦50mm、横50mmの角板)へ105CFUの細菌を接種後、試験片表面をポリエチレンフィルム(縦40mm、横40mm)で覆い、37℃、24時間培養した。培養終了後、ボルテックスにて試験片およびフィルム上の生菌を回収した。平板法にて生菌数を測定した後、下記の式に従って抗菌活性値(R)を計算した。
R = (HA試験片の生菌数の対数の平均値) ー (AG-PROTEX試験片の生菌数の対数の平均値)
JIS Z 2801規格に基づき、Rが2以上のとき、「抗菌性あり」と判定した。抗菌活性値が2以上とは、細菌を99%以上殺菌することを意味する。
AG-PROTEXの抗菌性試験
骨内抗菌試験(ラット脛骨モデル)(文献8)
AG-PROTEXの骨内における抗菌性を評価したところ、術後24時間~72時間において、AG-PROTEXの生菌数はHAに比べて有意に少なく、AG-PROTEXが生体内でも抗菌性を発揮することが確認されました(図6)。
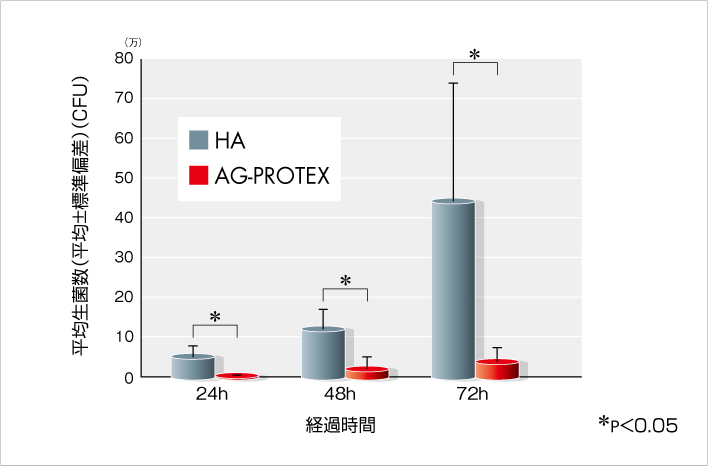
図6.骨内抗菌試験結果(n=5)
【試験概要】
10週齢のSDラットの脛骨骨髄腔にドリリングし、102CFUのMRSA菌液を注入後、AG-PROTEXおよびHA試験片(直径1mm、長さ20mm)を挿入して閉創した。術後24時間、48時間、72時間にて試験片の入った脛骨を取り出し、粉砕および超音波洗浄にて生菌を回収した後、平板法にて生菌数を測定した。
以上の結果から、AG-PROTEXは、抗菌スペクトルの広い銀を溶射被膜中に含有することにより、細菌付着を阻害し、細菌によるバイオフィルム形成を抑制することが確認され、生体内において抗菌性を発揮することが期待できます。
AG-PROTEXの骨伝導性
AG-PROTEXの骨内固定力
AG-PROTEXの溶射層の骨内固定力を Push Out 試験で確認した結果、AG-PROTEXはHAと同等の骨内固定力を有することが確認されました(図7)。
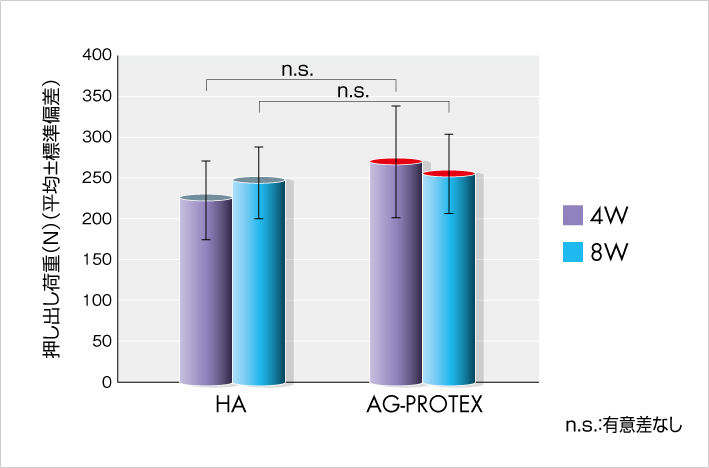
図7.骨内固定力試験結果(社内データ)(n=7 or 8)
【試験概要】
7~9週齢の日本白色ウサギ大腿骨の骨幹部にドリリングし、AG-PROTEXおよびHA試験片を大腿骨の長軸に対して垂直に埋入した。術後4週および8週にて試験片を含む大腿骨部を採取し、Push Out試験にて押し出し荷重を評価した。即ち、大腿骨部を専用冶具に固定し、万能試験機にて試験片に一定速度で荷重を加え、試験片の骨内固定が破断する最大の押し出し荷重を測定した。
骨内インプラント試験
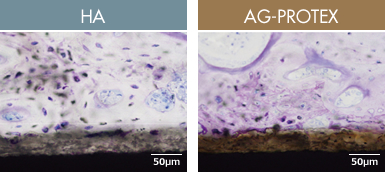
図8.埋入後4週の組織観察像 (社内データ)
ウサギ脛骨内埋植試験にてAG-PROTEXの骨伝導性を評価したところ、HA、AG-PROTEX共にコーティング層の表層に新生骨が形成され、結合状態も各所に認められることから、AG-PROTEXはHAと同様に優れた骨伝導性能を有するものと考えられます(図8)。
【試験概要】
7~9週齢の日本白色ウサギの脛骨骨幹部に貫通孔を形成し、AG-PROTEXおよびHA試験片(円柱面にコーティングを行った円柱状試験片)を埋入した。
術後4週にて試験片を含む脛骨を採取し、樹脂包埋による非脱灰標本を作製した。
トルイジンブルー染色後、光学顕微鏡にて観察した。
以上の結果から、AG-PROTEXは、従来のHAコーティングと同等の骨伝導性及び骨固定性を有することが確認され、生体内において、銀による抗菌性とHAによる骨伝導性、骨固定性を両立することが期待できます。
AG-PROTEXの安全性
生物学的安全性
厚生労働省より「医療機器の製造販売承認申請等に必要な生物学的安全性評価の基本的考え方について」(平成24年3月1日付け薬食機発0301第20号)が発出されています。
この通知および国際規格ISO10993-1:2009に基づき、AG-PROTEXの生物学的安全性試験を実施しています。この結果、下記の全ての試験において、各種の毒性は認められませんでした(表3)。
| 実施した試験項目 | 試験結果 |
|---|---|
| 細胞毒性試験 | 毒性無し |
| 刺激性試験(皮内反応) | 適合 |
| 皮膚感作性試験 | 皮膚感作性無し |
| 遺伝毒性試験(復帰突然変異) | 陰性 |
| 遺伝毒性試験(染色体異常) | 陰性 |
| 全身毒性(急性および亜急性) | 毒性無し |
| 埋植試験(骨内) | 組織傷害性を示さない |
表3.生物学的安全性試験結果
血清中銀濃度の推移 (文献9)
AG-PROTEX処理を施した製品を使用した初回人工股関節置換術症例(20例)の血清中における銀濃度を測定したところ、各測定時期における中央値は術後2週目をピークとして、徐々に低下していることが確認されました(図9)。
また、経過観察中、アルギリア症(銀皮症)および製品に起因する不具合は認められませんでした。
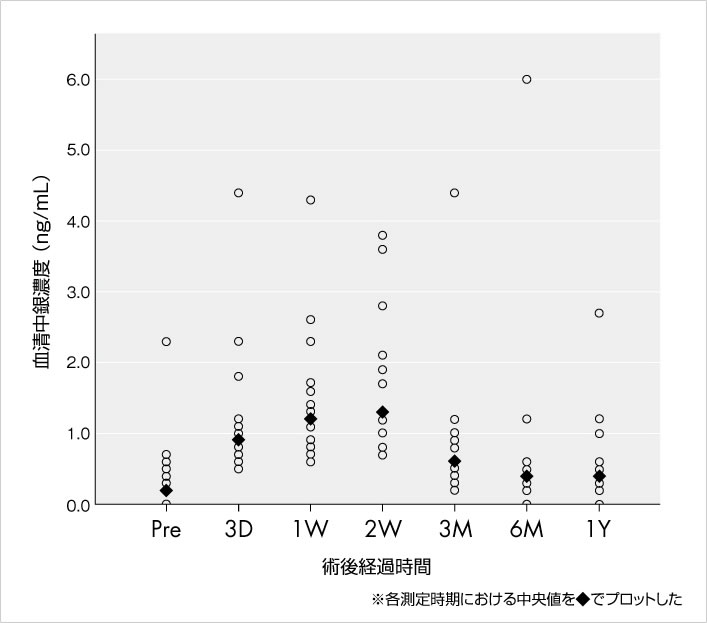
図9.血清中銀濃度測定結果
まとめ
以上、AG-PROTEXの抗菌性、骨伝導性及び安全性の結果から、AG-PROTEXは、抗菌性と骨伝導性を両立することに加えて、従来の製品と同様の安全性を有する表面処理技術であると考えられます。
参考文献
- 1.骨・関節術後感染予防ガイドライン2015 改訂第2版 南江堂 2015年5月1日発行
- 2.松下和彦他 : 整形外科領域の周術期感染予防.日本化学療法学会雑誌. Vol.60, No.3 : 319-326, 2012
- 3.Nakashima Y et al : Results at a minimum of 10 years of follow-up for AMS and PerFix HA-coated cementless total hip arthroplasty:
impact of cross-linked polyethylene on implant longevity. J Orthop Sci, 18, 6 : 962-968, 2013 - 4.Noda I et al : Development of Novel Thermal Sprayed Antibacterial Coating and Evaluation of Release Properties of Silver Ions.
J Biomed Mater Res B Appl Biomater, 89 : 456-465, 2009 - 5.吉野槇一:人工膝関節の合併症-治療と対策- 金原出版 2006年5月15日発行
- 6.Ando Y et al : Calcium phosphate coating containing silver shows high antibacterial activity and low cytotoxicity and inhibits bacterial adhesion.
Materials Science and Engineering C, 30 : 175-180, 2010 - 7.Noda I et al : Next Generation type Silver-containing Hydroxyapatite Coating. ORS 2015 Annual Meeting . Poster No: 1906
- 8.Akiyama T et al : Silver Oxide-Containing Hydroxyapatite Coating Has In vivo Antibacterial Activity in the Rat Tibia. J Orthop Res, 31, 8 : 1195-1200, 2013
- 9.Eto S et al : First Clinical Experience With Thermal-Sprayed Silver Oxide-Containing Hydroxyapatite Coating Implant. J Arthroplasty, 2015 [Epub ahead of print]
Resitageボックスケージ [医療機器承認番号:23100BZX00072000]
AG-PROTEX PC HIPステム [医療機器承認番号:23100BZX00017000]
AG-PROTEX HIPシステム [医療機器承認番号:22700BZX00259000]
「AG-PROTEX」は、京セラ株式会社の登録商標です。








